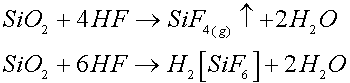
proprietà chimiche dei vetri
Stabilità chimica
Attacco dell’acido fluoridrico
Il vetro silicatico è attaccato a temperatura ambiente in maniera evidente dall’acido fluoridrico HF anche se la velocità di reazione è in genere bassa e decresce nel tempo a causa della permanenza dei prodotti di reazione sulla superficie.
Il meccanismo della reazione comporta un attacco del reticolo di silice con formazione di SiF4 gassoso o acido fluorosilicico H2SiF6
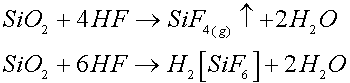
Reazione in un mezzo acquoso
Il reticolo silicico reagisce con acqua, il meccanismo proposto è il seguente: si ha la rottura di un ponte ossigeno con la formazione di gruppi terminali -OH, la reazione può proseguire con formazione di acido silicico Si(OH)4 che viene rimosso dall’ambiente di reazione sotto forma di sospensione colloidale.
![]()
La reazione è più rapida in presenza di elementi alcalini nel vetro essa è anche favorita da un ambiente debolmente acido; in questo caso si ha uno scambio ionico tra il protone H+ e lo ione alcalino R+, in seguito per l’aumento del pH del mezzo acquoso si ha un attacco alcalino con rottura del reticolo:
![]()
Reazione in soluzione alcalina:
I vetri silicatici sono attaccabili da soluzioni alcaline come possiamo vedere dalla reazione riportata più avanti , in questo caso il gruppo OH- funziona da catalizzatore e fa procedere la reazione con una velocità sufficientemente alta da provocare un severo attacco alla struttura silicea del vetro.
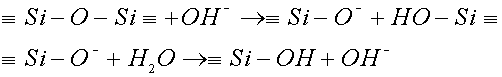
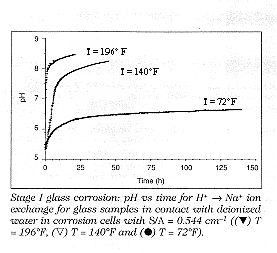
L’attacco di vetri alcalino-silicatici è condizionato dalla velocità di diffusione degli ioni alcalini sulla superficie e diminuisce in genere con la radice quadrata del tempo, esso è indipendente dalla forza dell’acido in quanto la velocità di reazione è scarsamente influenzata da pH della soluzione. I componenti principali dei vetri comuni da finestra sono SiO2 (73 %), Na2O (14%), CaO (8%) e MgO (4%), la durabilità chimica è garantita dall’introduzione di ioni di metalli alcalino-terrosi come il Ca++ che riducono la diffusione degli ioni alcalini alla superficie mentre lo ione Mg++ ha lo scopo principale di ampliare il range di lavorabilità. Ossidi degli elementi formatori di reticolo o formatori di reticolo condizionati come Al2O3, B2O3, ZnO, PbO aggiunti in piccola quantità aumentano la forza dei legami del network e quindi la stabilità chimica. Quando un vetro piano commerciale (vetro comune da finestra) entra in contatto con l’acqua lo ione H+ prodotto dalla dissociazione dell’acqua reagisce con la superficie del vetro con un processo di scambio ionico che abbiamo già visto che porta alla sostituzione di ioni Na+ del vetro con ioni H+ questo è anche chiamato I stadio della corrosione la reazione inizia immediatamente anche a temperatura ambiente, a mano a mano che gli ioni H+ vengono consumati si ha una rottura dell’equilibrio di dissociazione e nuove molecole di acqua si dissociano per fornire i protoni necessari alla reazione, in questo modo la concentrazione di OH- inizia a crescere facendo aumentare il valore del pH del mezzo acquoso, l’effetto della temperatura in questo stadio è rilevante come vediamo dal grafico in figura 1 dell’andamento del pH contro il tempo in un processo di scambio ionico H+« Na+ L’esperimento è stato condotto con acqua deionizzata in una cella di teflon con un rapporto superficie / volume estraente di 0,544 cm-1.
Figura 1
Il rapporto superficie di attacco /volume di soluzione estraente è molto importante: infatti se un grande volume d’acqua è in contatto con una superficie vetrosa la concentrazione ossidrilica rimane relativamente bassa e quindi è necessario un tempo maggiore per far crescere il pH al di sopra di 8,5 e dar luogo al II stadio della corrosione in cui i danni si fanno più rilevanti, d’altra parte un sottile film di condensa sulla superficie vetrosa provoca un rapido innalzamento del pH.
Questo fenomeno è di grande importanza commerciale quando si pensi che le lastre di vetro piano confezionate per il trasporto si trovano in media ad una distanza di 0,0127 cm l’una dall’altra e quindi si deve evitare il formarsi di condensa tra le lastre poiché in questo caso il pH del mezzo acquoso salirà molto rapidamente.
Il primo stadio del processo di corrosione termina quando il pH del mezzo acquoso ha raggiunto il valore di 8,5-9, a quel punto allo scambio ionico subentra la dissoluzione del network come si può osservare da esperimenti in camera di corrosione che mettono in evidenza, nel mezzo acquoso la presenza di prodotti della demolizione del network come metalli di modificatori di reticolo e silice, questo processo può provocare seri danni alla superficie del vetro fino alla frattura del materiale.
La corrosione nei vetri è funzione della loro composizione e delle condizioni ambientali come messo in evidenza da Douglas ed El Shamy in figura 2 osserviamo una alta velocità di estrazione dei metalli alcalini fino a pH 9 mentre per valori di pH superiori il grafico si inverte in favore del silicio, il punto di incrocio, chiamato pH di equilibrio del vetro, si trova tra pH 9 e 10 e dipende dalla composizione.
Nelle condizioni normali di utilizzo le variabili condizioni atmosferiche provocano una situazione dinamica sulla superficie del vetro che difficilmente consente il raggiungimento del secondo stadio della corrosione, il fenomeno corrosivo è trascurabile e limitato alla lisciviazione degli ioni alcalini nelle immediate vicinanze della superficie vetrosa; questo favorisce la formazione di uno strato vetroso ricco in silicio che, in assenza di innalzamenti di pH funziona da barriera contro un’ulteriore corrosione, a meno che condensazioni e successive evaporazioni del vapor acqueo presente non determinino una concentrazione di sali alla superficie ed un conseguente aumento della alcalinità.
Figura 2 Velocità di corrosione di un vetro silicatico in funzione del pH
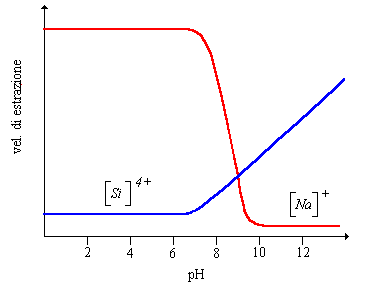
Figura 3 Fotografia al microscopio elettronico a scansione di una superficie di vetro danneggiata, , si noti la caratteristica struttura causata dall’attacco del reticolo di silice

Dipendenza dalla composizione
Figura 4
§ 8.11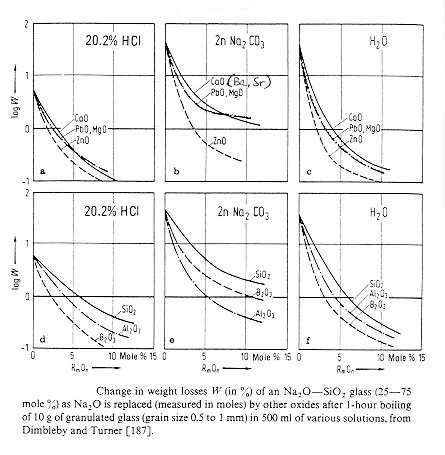
In figura 4 § 8.11 è mostrato il comportamento alla corrosione in vari mezzi di un vetro alcalino-silicatico (Na2O 25%, SiO2 75%) nel quale Na2O è sostituito da altri ossidi, si noti come in ambiente acido ZnO e PbO hanno un comportamento simile a quello degli ossidi dei metalli alcalino terrosi. Per quanto riguarda la resistenza in acqua essa aumenta nella serie: Zn < Mg < Ca < Pb < S r< Ba, è stato inoltre notato che l’aggiunta di ZrO2 ed in genere di ossidi del tipo R2O in composizione aumenta fortemente la resistenza sia agli acidi che agli alcali per la formazione di composti del tipo Zr(OH)4 piuttosto insolubile in acqua.
In figura 5 § 8.12 a-d osserviamo nel dettaglio il comportamento di alcuni ioni al variare del pH del mezzo:
Figura 5 Stabilità dello ZnO in soluzioni acquose a differenti pH (25°C)
§ 8.12a
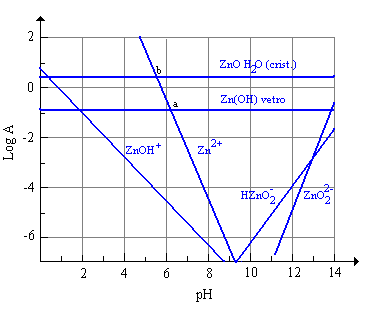
Al di sotto di pH 6,1 l’attività dello ione Zn2+ è maggiore di quella della specie ZnO H2O (a) quindi il vetro nella cui composizione è presente ZnO sarà suscettibile di attacco acido già al di sotto di pH 5,5. Per quanto riguarda la resistenza di vetri contenenti zinco ad ambienti alcalini, l’attività delle specie HZnO2- e ZnO22- è minore di quella dello ZnO H2O e quindi si avrà un vigoroso attacco alcalino solo a pH > 13, l’aggiunta di ZnO aumenterà la durabilità chimica del vetro nell’intervallo 5,5 > pH < 13
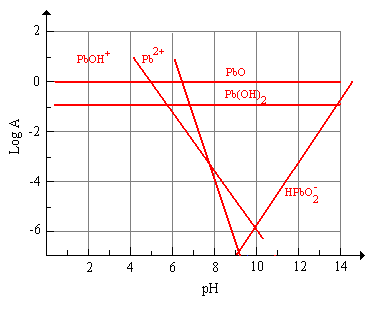
Nella figura 6 § 8.12b si vede che a pH minore di 6,8 il piombo presente sulla superficie del vetro comincia a dissolversi, prima come Pb2+ e quindi come Pb(OH)+, la specie HPbO2- si forma in ambiente fortemente alcalino, infatti la sua attività è maggiore di quella della specie Pb(OH)2 a pH > 14,5. I vetri contenenti piombo hanno una ottima durabilità in ambiente alcalino mentre in ambiente acido la deplezione del Pb2+ dipende da numerosi fattori: se il piombo nel vetro agisce da network former o modifier, dalla sua concentrazione e dalla natura del mezzo acido; ad esempio l’acido cloridrico ha un effetto minore dell’acido nitrico sulla durabilità di un vetro piombico a causa della formazione di specie clorurate poco solubili.
Figura 6 Stabilità dello PbO in soluzioni acquose a differenti pH (25°C)
§ 8.12b
La figura 7 § 8.12c rappresenta la stabilità del Al2O3 in soluzioni acquose al variare del pH, le specie solubili Al3+ e AlO2- predominano a pH inferiori a 3,2 e superiori a 12, un vetro contenente alluminio diviene sensibile al pH a valori inferiori a 4, è per questo motivo che composizioni vetrose contenenti alluminio sono utilizzate nella fabbricazione di elettrodi specifici (Ross).
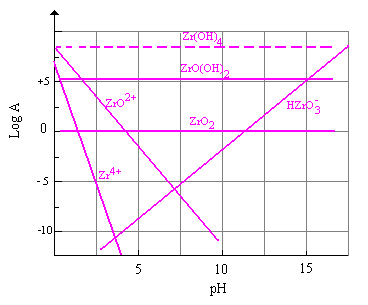
Lo zirconio, (figura 8) § 8.12d incrementa la durabilità all’attacco acido e basico anche con vetri contenenti basse concentrazioni di ossido.
Figura 7 Stabilità dell’Al2O3 in soluzioni acquose a differenti pH (25°C)
§ 8.12c
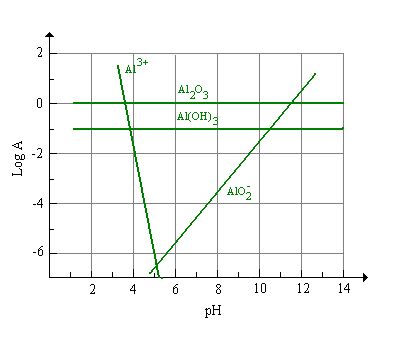
Figura 8 Stabilità dello ZrO2 in soluzioni acquose a differenti pH (25°C)
§ 8.12c
Metodi di controllo
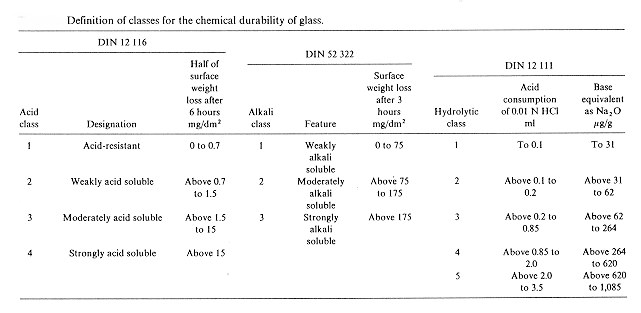
La tabella 1 § 8.10 riporta la classificazione dei vetri secondo normativa DIN in base alla resistenza agli acidi (DIN 12116) agli alcali (DIN 52322) ed in acqua (DIN 12111).
Tabella 1
§ 8.10
Resistenza agli acidi
Un campione di vetro della forma di una lastra con facce parallele e di superficie minima di 300 cm2 viene fatto bollire in una soluzione 6N di HCl, la classe di appartenenza viene stabilita in base alla perdita in peso espressa in mg. per dm2 di superficie.
Resistenza agli alcali
Il campione di superficie compresa tra 10 e 15 cm2 viene fatto bollire in una capsula di argento a riflusso per 3 h con una soluzione 1N di NaOH e Na2CO3, anche in questo caso la classe di appartenenza viene stabilita in base alla perdita in peso espressa in mg. per dm2 di superficie.
Resistenza in acqua
Due grammi di vetro macinato (dimensioni delle particelle 0,315-0,5 mm) vengono scaldati a 98° C per 60’ in 50 mL di acqua distillata, la soluzione risultante viene titolata con una soluzione 0,01 N di HCl fino a viraggio con rosso metile, la classe di appartenenza viene stabilita dai mL di soluzione acida consumata per arrivare al punto di viraggio.
NOTA
Per quanto riguarda le superfici smaltate di supporti ceramici vengono utilizzate le norme EN 122.
Trasformazioni superficiali dei vetri
Le modificazioni superficiali dei vetri sono state raggruppate da Hench in cinque tipologie principali (figura 9):
Superficie di tipo I : è una superficie idrata di spessore molto sottile inferiore a 5 nm che dà origine ad un vetro molto resistente senza che vi siano evidenti cambiamenti composizionali.
Superficie di tipo II : in questo caso si forma uno strato superficiale ricco in silice a causa della perdita in alcali per reazione di scambio ionico senza tuttavia che vi sia distruzione del network siliceo; anche in questo caso si ha superficialmente la formazione di un vetro all’idrogeno che aumenta la durabilità della superficie del manufatto.
Superficie di tipo IIIa IIIb : si creano in questo caso degli strati protettivi a base di silicati o di altri idrossidi inerti all’attaco chimico , siamo in presenza di vetri estremamente durabili sia in ambiente acido che alcalino. In questo caso la presenza di ioni Al3+ riduce fortemente la corrosione del vetro per la formazione di un idrossido di alluminio.
Superficie di tipo IV: si crea un film superficiale di un vetro ricco in silice ma in questo caso si ha la progressiva distruzione del reticolo siliceo spesso dovuta all’insufficiente contenuto in vetro-formatori (SiO2) (<66,7% Mol) tale da garantire il legame via ponti ad ossigeno della struttura.
Superficie di tipo V: è tipica di un vetro molto solubile in un mezzo acquoso; l’attacco in questo caso procede con velocità uniforme mentre la superficie che subisce l’attacco viene continuamente rinnovata tanto da trarre in inganno l’osservatore ed apparire del 1° tipo.
Figura 9 : I cinque tipi di superficie vetrosa definiti da Hench (1982)
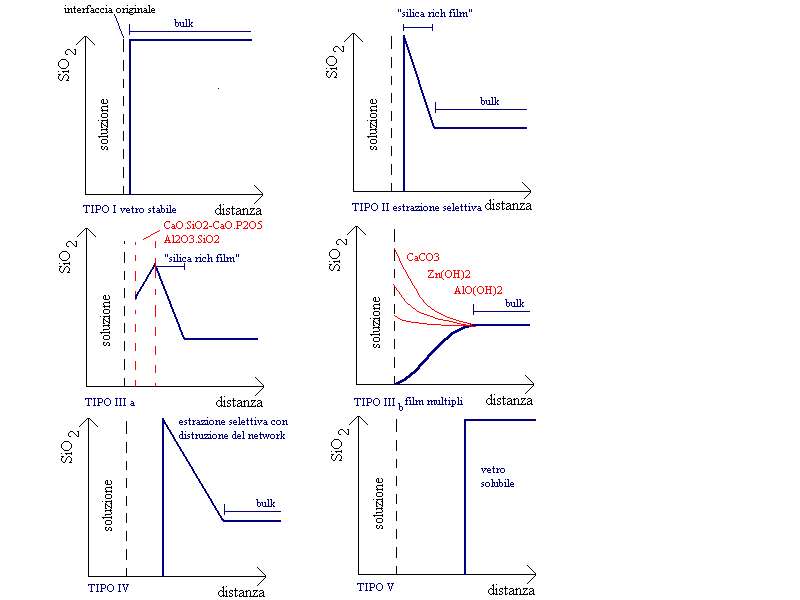
Figura 11.: schema delle più frequenti cause di deterioramento di una superficie di un vetro

Figura 12 : Immagine al microscopio elettronico del film superficiale di alterazione del campione B, dalla analisi EDS si rileva presenza di un’elevata percentuale di manganese
